Viên nén bao phim Tormeg-20 điều trị bệnh tim mạch, hạ lipid máu không đạt tiêu chuẩn
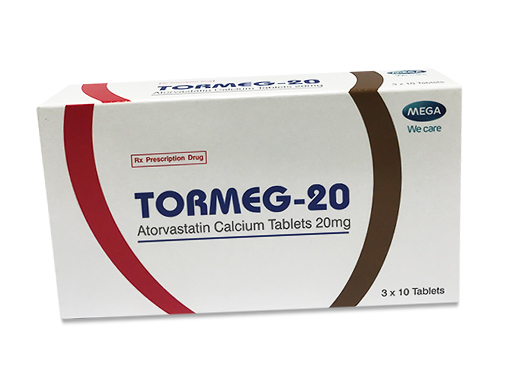
Được biết, viên nén bao phim Tormeg-20 có chứa Atorvastatin calci là một chất hạ lipid tổng hợp, chất ức chế enzym khử 3-hydroxy-3-methylglutaryl-coenzym A (HMG-CoA). Atorvastatin được chỉ định dùng hỗ trợ với chế độ ăn kiêng để làm giảm cholesterol toàn phần, LDL-cholesterol, apolipoprotein B và triglycerid ở các bệnh nhân cao cholesterol máu nguyên phát, cao cholesterol máu do di truyền dị hợp tử hoặc cao lipid máu hỗn hợp.
Atorvastatin được chỉ định dùng hỗ trợ chế độ ăn kiêng để điều trị những bệnh nhân bị cao triglycerid huyết thanh và điều trị các bệnh nhân bị rối loạn betalipoprotein máu nguyên phát mà không có đáp ứng đầy đủ với chế độ ăn kiêng.
Dự phòng bệnh tim mạch: Làm giảm nguy cơ nhồi máu cơ tim ở người lớn bị cao huyết áp không có bệnh động mạch vành lâm sàng, nhưng có tối thiểu 3 nguy cơ của bệnh động mạch vành như tuổi trên 55, đàn ông, hút thuốc lá, tiểu đường loại 2, phì đại thất trái, có các bất thường đặc hiệu trên điện tâm đồ, protein niệu, tỷ lệ của cholesterol toàn phần trong huyết tương so với cholesterol có trọng lượng phân tử cao ≥ 6, hoặc gia đình có tiền sử bị bệnh động mạch vành trước tuổi trưởng thành.
Cục quản lý Dược, Bộ y tế vừa có thông báo thu hồi thuốc viên nén bao phim Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 do Công ty Pharmathen S.A, Greece sản xuất, Chi nhánh Công ty cổ phần dược phẩm TBYT Hà Nội (Hapharco) nhập khẩu tại các cơ sở kinh doanh dược, cơ sở khám bệnh, chữa bệnh trên địa bàn TP.HCM.
Cục yêu cầu Chi nhánh Công ty cổ phần dược phẩm TBYT Hà Nội (Hapharco) phối hợp với các cơ sở phân phối thuốc phải trong thời hạn 2 ngày kể từ ngày 22.5.2020, gửi thông báo thu hồi tới cơ sở bán buôn, bán lẻ, sử dụng thuốc Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 do Công ty Pharmathen S.A, Greece sản xuất, Chi nhánh Công ty cổ phần dược phẩm TBYT Hà Nội (Hapharco) nhập khẩu và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nói trên trên địa bàn TP.HCM.
Gửi báo cáo thu hồi về Cục quản lý Dược, Sở y tế TP.HCM trong thời hạn 33 ngày kể từ ngày 22.5.2020, bao gồm số lượng nhập khẩu, số lượng phân phối, số lượng thu hồi trên địa bàn TP.HCM, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định hiện hành.
Báo cáo tình hình nhập khẩu (thời gian, số lượng nhập khẩu), phân phối (tên, địa chỉ của các cơ sở kinh doanh đã mua thuốc, số lượng cung cấp) lô thuốc Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 về Cục quản lý Dược, Viện kiểm nghiệm thuốc trung ương, viện kiểm nghiệm thuốc TP.HCM trong vòng 3 ngày kể từ ngày 22.5.2020.
Phối hợp với các cơ quan kiểm tra chất lương, cơ quan kiểm nghiệm thuốc nhà nước tiến hành lấy mẫu bổ sung tại ít nhất 1 cơ sở bán buôn khác không thuộc địa bàn TP.HCM và 1 cơ sở bán buôn đã cung cấp thuốc cho Bệnh viện đa khoa Sài Gòn. Địa điểm lấy thuốc do cơ quan kiểm tra chất lượng. Cơ quan kiểm nghiệm thuốc lựa chọn và quyết định trên cơ sở báo cáo của công ty.
Gửi mẫu đã lấy tới Viện kiểm nghiệm thuốc trung ương hoặc Viện kiểm nghiệm thuốc TP.HCM để kiểm tra chất lượng đối với chỉ tiêu định lượng. Báo cáo kết quả kiểm tra chất lượng trong vòng 15 ngày kể từ ngày nhận được mẫu về Cục quản lý Dược để có căn cứ xử lý tiếp theo.


Yêu cầu Bệnh viện đa khoa Sài Gòn tiến hành thu hồi toàn bộ số thuốc Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 không đạt tiêu chuẩn chất lượng nêu trên tại bệnh viện. Báo cáo thu hồi gửi về Cục quản lý Dược, Sở y tế TP.HCM trong thời hạn 33 ngày kể từ ngày 22.5.2020.
Viện kiểm nghiệm thuốc trung ương và Viện kiểm nghiệm thuốc TP.HCM ưu tiên tiến hành kiểm tra chất lượng đối với chỉ tiêu định lượng của các mẫu lấy bổ sung đối với thuốc Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 do Công ty Pharmathen S.A, Greece sản xuất, báo cáo kết quả về Cục quản lý Dược.
Đề nghị Sở y tế TP.HCM công bố thông tin thu hồi lô thuốc Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 trên trang thông tin điện tử của sở. Kiểm tra và giám sát Chi nhánh Công ty cổ phần dược phẩm TBYT Hà Nội (Hapharco) và Bệnh viện đa khoa Sài Gòn thực hiện thu hồi trên địa bàn, báo cáo tình hình phân phối và việc gửi mẫu bổ sung để kiểm tra chất lượng lô thuốc Tormeg-20 (Atorvastatin 20mg), SĐK: VN-18783-15, số lô: 0807065, ngày sản xuất: 22.10.2018, hạn dùng: 22.10.2020 nêu trên theo quy định.
Tormeg-20 thuộc nhóm thuốc tim mạch, thuốc hạ lipid máu, được chỉ định sử dụng cho bệnh nhân mắc bệnh mạch vành hoặc có nguy cơ mắc bệnh tim mạch, nhồi máu cơ tim hay đột quỵ; người bị rối loạn betalipoprotein máu chính mà không điều chỉnh được hoặc không cải thiện qua chế độ dinh dưỡng. Thuốc cũng được sử dụng ở những người bệnh đái tháo đường type 2 nhưng có nguy cơ bệnh mạch vành cao; Thuốc được bổ sung thêm chế độ dinh dưỡng ở những bệnh nhân bị tăng cholesterol máu, rối loạn lipid máu hỗn hợp;…
Sức Khỏe 24H sẽ tiếp tục thông tin.
a) Cơ sở có thuốc bị thu hồi có văn bản gửi Bộ Y tế (Cục Quản lý Dược) kèm theo quy trình khắc phục, đánh giá nguy cơ đối với chất lượng, độ ổn định của thuốc, Chương trình theo dõi, giám sát chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành;
b) Trong thời hạn tối đa 60 ngày, kể từ ngày nhận được văn bản đề nghị khắc phục của cơ sở, Bộ Y tế (Cục Quản lý Dược) phải xem xét, có ý kiến trả lời bằng văn bản đồng ý hoặc không đồng ý việc khắc phục. Trường hợp không đồng ý phải nêu rõ lý do;
c) Trường hợp cần bổ sung hoặc làm rõ thông tin liên quan đến việc khắc phục, trong thời hạn tối đa 60 ngày, kể từ ngày nhận được văn bản của Bộ Y tế (Cục Quản lý Dược), cơ sở phải nộp tài liệu bổ sung, giải trình. Sau thời hạn trên, cơ sở không nộp tài liệu bổ sung, giải trình thì đề nghị khắc phục không còn giá trị.
Thủ tục đề nghị tái xuất thuốc bị thu hồi:
a) Cơ sở có thuốc bị thu hồi có văn bản gửi Bộ Y tế (Cục Quản lý Dược) kèm theo phương án tái xuất nêu rõ thời gian và nước tái xuất;
b) Trong thời hạn tối đa 15 ngày, kể từ ngày nhận được văn bản đề nghị của cơ sở, Bộ Y tế (Cục Quản lý Dược) có ý kiến trả lời bằng văn bản đồng ý hoặc không đồng ý tái xuất; trường hợp không đồng ý phải nêu rõ lý do.
- Sản phẩm vì sức khỏe
-
Đắk Lắk: Hưởng ứng Ngày Thế giới không thuốc lá và Tuần lễ quốc gia không thuốc lá
UBND tỉnh Đắk Lắk vừa ban hành Công văn số 4533/UBND-KGVX, gửi các sở, ban, ngành, đoàn thể; UBND các huyện, thị xã, thành phố về việc thực hiện Công văn số 2484/BYT-KCB ngày 25/4/2025 của Bộ Y tế về tổ chức hoạt động hưởng ứng Ngày Thế giới không thuốc lá 31/5, Tuần lễ quốc gia không thuốc lá 25/5 - 31/5 và tăng cường thực thi Luật Phòng, chống tác hại của thuốc lá.May 11 at 9:45 am -
TP. HCM: Tăng cường đảm bảo an toàn lao động trong thi công xây dựng công trình
Văn phòng UBND TP. HCM có văn bản truyền đạt ý kiến chỉ đạo của Phó Chủ tịch UBND TP. HCM Bùi Xuân Cường về tiếp tục tăng cường công tác đảm bảo an toàn lao động trong thi công xây dựng công trình.May 11 at 9:45 am -
Chủ động bảo vệ sức khỏe trong mùa nắng nóng
Nhiệt độ cao kéo dài tại nhiều địa phương trên cả nước, gây ảnh hưởng đến sức khỏe cộng đồng, đặc biệt là người lao động làm việc ngoài trời. Tình trạng say nắng, say nóng, thậm chí đột quỵ có thể xảy ra nếu cơ thể phải tiếp xúc lâu với môi trường oi bức hoặc thay đổi nhiệt độ đột ngột. Việc nhận biết sớm các nguy cơ và chủ động phòng tránh là điều hết sức cần thiết trong thời điểm này.May 5 at 2:11 pm -
Cà Mau: Sôi nổi sự kiện thể thao, du lịch “Hương rừng U Minh” năm 2025
Sáng 1/5, tại Vườn Quốc gia U Minh Hạ, Sở Văn hóa, Thể thao và Du lịch tỉnh Cà Mau phối hợp tổ chức sự kiện thể thao, du lịch “Hương rừng U Minh” năm 2025. Hoạt động thu hút hơn 650 vận động viên là cán bộ, công chức, viên chức, người lao động đến từ các sở, ban, ngành trong tỉnh tham gia.May 2 at 10:35 am